子宫内膜癌(Endometrial cancer,EC)在全球范围内是女性中第六位最常见的恶性肿瘤,其发病率呈现逐年上升的趋势。虽然早期子宫内膜癌患者的预后相对较好,但对于原发性晚期或复发性子宫内膜癌患者而言,中位总生存期往往不超过三年。目前,根据遗传突变信息,子宫内膜癌被划分为四种亚型:POLE超突变型、高微卫星不稳定性型、低拷贝数型和高拷贝数型,每种亚型都展现出不同的预后和对药物的反应。在这些亚型中,高拷贝数亚型的患者在TP53基因上的突变率高达90%,而PTEN基因的突变率相对较低,且这些患者的无进展生存期最短。
蛋白质的翻译后修饰对细胞的生理和病理功能具有深远影响。除了广为人知的磷酸化和泛素化修饰之外,糖基化和乳酰化等新兴领域的研究正迅速兴起。异常糖基化是肿瘤恶性进展中极为常见的生物学事件,它通过影响蛋白质的折叠、分布和稳定性,进而调控细胞的增殖、转移和免疫逃逸等关键功能。糖相关生物标志物在肿瘤的早期诊断、无创检测、疗效监控、患者分层以及新抗原发现等精准医疗领域具有巨大的潜力,但由于糖链的复杂性以及糖蛋白组学分析技术瓶颈,在包括预后最差的这部分EC患者中,糖基化相关基因(Glycogene,包括糖基转移酶、糖苷酶和核苷酸糖合成/转运蛋白基因)是否为关键的疾病驱动因子,能否成为潜在的药物干预靶点,均亟需阐明。

继之前基于Glycogene对膀胱癌开展分子分型并发现受腔型膀胱癌关键转录因子GATA3负调节的唾液酸转移酶ST3GAL6是导致膀胱癌的不良预后且参与肿瘤细胞侵袭(Theranostics 2021),2024年11月11日来自复旦大学的严俊博士的科研团队联合中国科学院上海药物研究所黄锐敏博士团队在Advanced Science上在线发表了题为“MGAT4A/Galectin9-driven N-glycosylation aberration as a promoting mechanism for poor prognosis of endometrial cancer with TP53 mutation”的研究论文。该研究报道了基于Glycogene的EC新型分子分型系统,阐明了过量表达的α-1,3-甘露糖基糖蛋白4-β-N-乙酰氨基葡萄糖氨基转移酶A(MGAT4A)与半乳糖凝集素-9(Galectin-9)协同驱动的异常N-糖基化修饰,通过糖酵解途径,导致携带突变TP53基因的EC病患的不良预后。
作者通过无监督层次聚类分析,利用公共子宫内膜癌数据库TCGA-UCEC,识别出一个包含11个糖基化相关基因的基因簇,能明确指征预后不良且富含TP53突变的EC病患。MGAT4A是该基因簇中最具代表性的糖基转移酶。在Galβ1-4GlcNAcβ阅读器Galectin-9的协同下,上调的MGAT4A在体外和体内均能通过促进葡萄糖代谢增加EC细胞的增殖和侵袭。N-糖蛋白质组学进一步鉴定出葡萄糖转运蛋白GLUT1是被MGAT4A修饰的糖蛋白之一:MGAT4A催化形成的分支型N-糖链后续与Galectin-9结合后,能增加GLUT1蛋白在细胞膜上的分布,致使葡萄糖摄取升高。此外,我们还揭示了野生型p53通过三种抑癌性的miRNA(miR-34a、miR-449a和miR-449b)间接下调MGAT4A,而p53突变体则丧失了对MGAT4A表达的抑制作用,最终导致患者预后不佳。
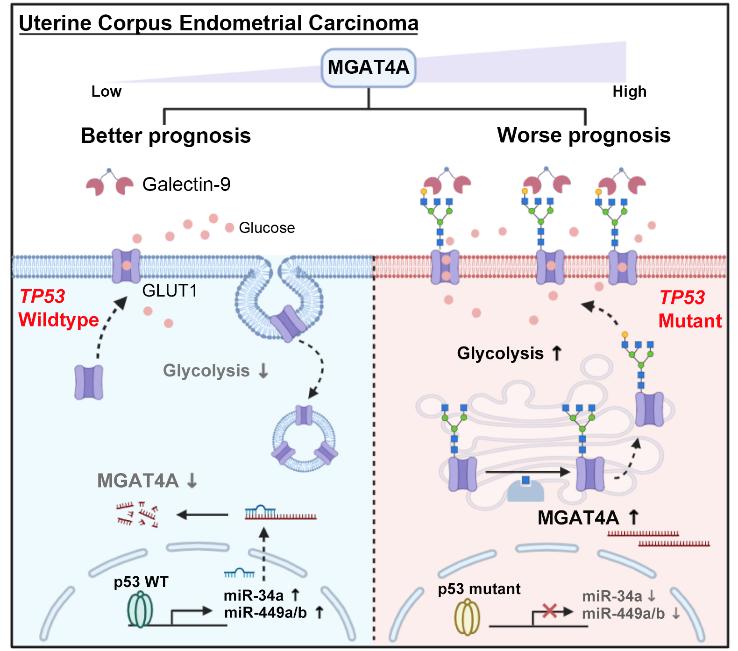
综合上述研究,作者已经证实MGAT4A,作为一种催化GlcNAc转移的糖基转移酶,能够成为预测子宫内膜癌不良预后的新生物标志物。他们还发现了一个新的调控轴——p53/miRNAs/MGAT4A,这一发现解释了在TP53突变的子宫内膜癌患者中MGAT4A表达的上调现象。此外,研究团队提出了一种N-糖链与半乳糖凝集素协同作用的新模型,即MGAT4A催化形成的分支型N-糖链能够增强膜蛋白GLUT1与Galectin-9的结合能力,这不仅延长了GLUT1在细胞膜上的驻留时间,还增加了葡萄糖的摄取量。这些发现揭示了与p53突变体相关的子宫内膜癌中,基于葡萄糖代谢关键调节因子的异常N-糖基化,这是导致肿瘤恶性进展的新调控机制。因此,直接阻断GLUT1的活性或间接干扰GLUT1的N-糖基化,可能成为针对TP53突变的子宫内膜癌患者的潜在治疗策略。
原文链接:https://onlinelibrary.wiley.com/doi/full/10.1002/advs.202409764